
Sichere Produktentwicklung mit PLM
Product Lifecycle Management in der Medizintechnik
Die Entwicklung medizintechnischer Hightech-Produkte unterliegt engen rechtlichen Vorschriften und Zulassungsverfahren und ist daher mit einem hohen Aufwand für Dokumentation sowie Risiko- und Qualitätsmanagement verbunden. Um diesen Herausforderungen zu begegnen, lohnt sich gerade in der Medizintechnikbranche der Einsatz neuer Methoden und informationstechnischer Werkzeuge. Der in anderen Industriezweigen entwickelte Ansatz des Produktlebenszyklusmanagements (PLM) bietet daher MedTech-Unternehmen vielversprechende Vorteile, um im globalen Wettbewerb mit innovativen Produkten nachhaltig zu bestehen.
Unser Wirtschaftssystem ist durch die verschiedensten Entwicklungen in Gesellschaft, Technik und Umwelt permanenten Veränderungen unterworfen. Dabei lassen sich einige bedeutende Entwicklungslinien als sogenannte Megatrends ablesen [1], die in erheblichem Maße auch die Medizintechnik betreffen. An erster Stelle steht die Globalisierung als Veränderungstreiber. Durch sie wachsen Industrien, Märkte und Gesellschaften weltweit zusammen. Für die Medizintechnik bedeutet es, dass die Märkte weltweit bedient werden können und Produkte in globalen Zulieferketten sowohl entwickelt als auch produziert werden.
Weitere Megatrends sind der nachhaltige Umgang mit Ressourcen und Klimaschutz, die auch in der Medizintechnik zunehmend gefordert werden. Bereits in der Entwicklung von Produkten werden beide Aspekte berücksichtigt und so die Produktion und die spätere Nutzung des Produkts ökologisch und ökonomisch nachhaltig gestaltet.
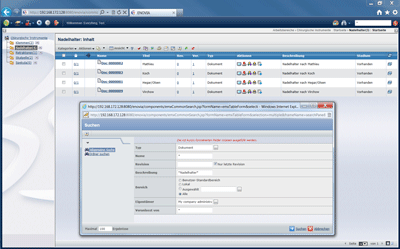
Bild 1: Verwaltung einer Produktpalette in einem PLM-System.
Auch der technologische Fortschritt hat einen wesentlichen Einfluss auf medizinische Produkte. Die neuesten Errungenschaften aus der Informations- und Kommunikationstechnik werden beispielsweise durch Miniaturisierung oder Anwendungen im Bereich e-Health für neuartige Produkte genutzt. Ein weiterer bedeutender Trend in der Medizintechnik wird durch die sog. personalisierte Medizin geprägt, wobei durch geschickte Kombination neuartiger Analyseverfahren und flexibel anpassbarer Technologien individuelle Lösungen geschaffen werden.
Herausforderungen für Medizingerätehersteller
Die Sicherheit medizintechnischer Geräte und die Vermeidung folgenschwerer Fehlfunktionen dieser Produkte haben eine zunehmend größere Bedeutung. Hohe Schadensersatzleistungen, kostspielige Rückrufaktionen und der gute Ruf eines Unternehmens stehen hier auf dem Spiel. Damit und aus den oben genannten Trends ergeben sich vielfältige Herausforderungen für die Hersteller von Medizintechnikprodukten. Die Medizinprodukterichtlinie bzw. das Medizinproduktegesetz fordert, anders als bei Produkten aus vielen anderen Branchen, von jedem Hersteller einen expliziten Nachweis, wie er die Sicherheit seiner Produkte gewährleistet und führt so zu hohen Anforderungen bei der Zulassung neuer medizinischer Produkte [2]. Der Aufwand vervielfacht sich, wenn international tätige Hersteller für alle Zielmärkte die relevanten Zulassungsbedingungen erfüllen müssen. Es gilt zum einen, die vielfältigen Regularien zu kennen, und zum anderen, die eigene Entwicklung und Produktion zulassungskonform zu gestalten. Es gibt daher am Anfang der Produktentwicklung eine ausgedehnte Konzeptphase, in der die zulassungsrelevanten Produktanforderungen frühzeitig und ggf. in mehreren Stufen geklärt werden [3]. Im Zusammenhang mit diesen „Regulatory Affairs“ sind bei der Zulassung medizintechnischer Geräte in Abhängigkeit der Risikoklasse auch klinische Bewertungen bzw. klinische Studien durchzuführen, deren umfangreiches Datenmaterial sowohl bzgl. der Planung als auch der Durchführung verwaltet werden muss.
Weitere herausragende Besonderheiten in der Medizintechnik sind der hohe Forschungsaufwand und die multidisziplinäre Entwicklung [4]. Moderne medizintechnische Produkte bestehen oftmals aus mechanischen, elektrischen und elektronischen Bauteilen sowie Software-Komponenten. In der Produktentwicklung müssen diese technischen Disziplinen kooperieren und sich zusätzlich mit Medizinern und Naturwissenschaftlern abstimmen. Nur so können innovative Produkte erfolgreich entwickelt, in aufwändigen klinischen Studien in ihrer Wirkungsweise auf den Organismus Mensch untersucht und die geforderte Produktsicherheit hergestellt werden.
Darüber hinaus müssen die Hersteller ein Risikomanagement realisieren, das auch noch nach dem Inverkehrbringen der Produkte wirksam ist, da auch während der Produktnutzung ihre Verantwortung bestehen bleibt.
Dokumentenmanagement und Informationsbereitstellung
Eine wichtige Strategie, um die hohen Anforderungen an die Dokumentation sowohl des Medizinprodukts selbst als auch der Entwicklungs- und Herstellungsprozesse zu erfüllen, ist eine durchgängige digitale Informationsverarbeitung. Ein wichtiger Baustein dafür ist ein in die Prozesse integriertes Dokumentenmanagementsystem, mit dem Dokumente versioniert und revisionssicher verwaltet werden. Beginnend in den frühen Phasen, wenn neue Produktideen entwickelt und die Umsetzungsmöglichkeiten evaluiert werden, müssen alle entscheidungsrelevanten Informationen dokumentiert und für den gesamten weiteren Produktlebenszyklus verfügbar gehalten werden [5]. Missverständnisse, Fehler sowie Nacharbeiten werden vermieden und somit die späteren Zulassungen vereinfacht. Dies gilt auch für den Fall, dass verschiedene Unternehmen in Zulieferketten kooperieren. Für ein solches Netzwerk ist eine gemeinsame Plattform erforderlich, um Dokumente auszutauschen und die Projektarbeit zu koordinieren [6].
Ein weiteres Potenzial der Informationstechnik ergibt sich aus der zielgerichteten Nutzung vorhandener Informations- und Wissensquellen innerhalb und außerhalb der Unternehmen. Die große Herausforderung ist, diese auch tatsächlich nutzbar zu machen, da sie meist sehr heterogen und dazu häufig auch unstrukturierte Informationen anbieten. Beispielsweise liegen die zulassungsrelevanten Richtlinien und Gesetze genauso als Text vor wie Patente, Marktanalysen und Erfahrungen aus der Produktnutzung. Diese Daten müssen geeignet aufbereitet werden, damit sie effektiv nutzbar sind [7].
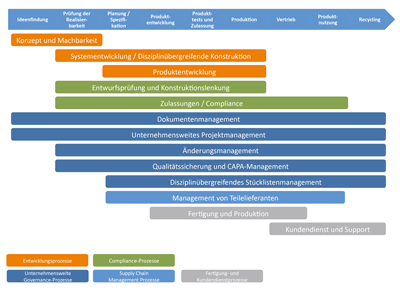
Bild 2: Integrierte PLM-Lösungen für den gesamten
Lebenszyklus medizinischer Produkte (nach [10]).
Ganzheitliche Lösung mit PLM
Um die oben beschriebene Durchgängigkeit der Informationstechnik zu erreichen, werden in der Industrie oftmals Methoden des Produktlebenszyklusmanagements angewandt [8]. PLM wird dabei als ein ganzheitlicher Ansatz verstanden, um ein Produkt auf seinem kompletten Lebensweg durch alle Prozesse und Phasen dokumentiert zu begleiten und die produktbezogenen Daten umfassend zu verwalten. Dabei arbeiten alle Bereiche eines Unternehmens wie Forschung, Entwicklung und Fertigung sowie Einkauf, Vertrieb und begleitende Unternehmensfunktionen wie Qualitätsmanagement immer mit den aktuellsten Versionen relevanter Dokumente. Bei Bedarf können auch Entwicklungs- oder Teilelieferanten einbezogen werden, um in der Zusammenarbeit eine optimale Produktqualität bei gleichzeitig geringeren Kosten zu erreichen. Die Umsetzung eines solchen Ansatzes erfordert die Optimierung der Unternehmensabläufe sowie den Einsatz eines geeigneten, auf die Anforderungen der Anwender zugeschnittenen PLM-Systems zur informationstechnischen Unterstützung dieser Prozesse [9]. PLM-Plattformen wie Windchill von PTC, CIM DATABASE von Contact Software oder Enovia V6 von Dassault Systèmes bieten eine Basis für eine durchgängige Unterstützung des PLM-Ansatzes. Dabei bezieht das PLM-System die komplette Produktpalette ein und bietet einen globalen Zugriff auf sämtliche produktrelevante Datensätze aller Produkte. Das Beispiel in Bild 1 zeigt, wie aus einer Auswahl chirurgischer Instrumente mit Enovia V6 die Dokumente der zu einer Produktgruppe gehörenden, verschiedenen Nadelhalter übersichtlich verwaltet werden.
Gerade bei Unternehmen der Medizintechnik mit ihrem hohen Entwicklungs- und Dokumentationsaufwand verstärkt der Einsatz eines PLM-Systems deren Innovationskraft. In besonderem Maße profitieren die Produktentwickler dabei von Medizintechnik-spezifischen Erweiterungen wie beispielsweise dem “ENOVIA Life Science Accelerator für Produktqualität und Regulatory Affairs”, die sie in allen Entwicklungsphasen durchgängig unterstützen, Planungsprozesse effizienter durchzuführen und dabei die hohen Qualitätsstandards und weiteren rechtlichen Anforderungen einzuhalten. Diese spezifischen Erweiterungen sind auf die besonderen Herausforderungen der Medizingerätehersteller ausgerichtet und unterstützen sie u.a. in den Bereichen Regulatory Affairs inklusive der Verwaltung der zulassungsrelevanten Dokumente unter Einhaltung der notwendigen Zulassungsprozesse sowie in der multidisziplinären Zusammenarbeit.
Der Lösungsansatz PLM hat den besonderen Reiz, dass verschiedene Management-Methoden mit einem System integriert unterstützt werden. Bild 2 zeigt einen Überblick über die wichtigsten Tätigkeiten innerhalb des Lebenszyklus medizintechnischer Produkte, die durch den Einsatz eines PLM-Systems unterstützt werden können. Die folgenden Funktionen realisieren diese Unterstützung:
- Dokumentenmanagement ermöglicht die revisionssichere Verwaltung der zulassungsrelevanten Dokumente innerhalb des gesamten Produktlebenszyklus.
- Produktdatenmanagement erweitert das Dokumentenmanagement um die zentrale Verwaltung aller entwicklungsrelevanten Informationen zu einem Produkt.
- Projektmanagement sichert die Durchführung der langlaufenden Forschungs- und Entwicklungsprojekte ab.
- Die Kooperationsplattform erleichtert die organisations- und disziplinübergreifende Zusammenarbeit in der Systementwicklung und sorgt für einen reibungslosen Informationsaustausch.
- Durch sogenannte Workflows forciert das Prozessmanagement die sichere und nachvollziehbare Durchführung der Entwicklungsprozesse.
- Änderungsmanagement implementiert zuverlässige organisationsübergreifende Änderungsprozesse.
- Supply Chain Management erleichtert die Arbeit in Zulieferketten.
- Stücklistenverwaltung ermöglicht den Austausch der Produktstruktur über die unterschiedlichen beteiligten Disziplinen.
Die zugrundeliegende Technologie des PLM-Systems ermöglicht auch die Beschreibung von automatisierten Workflows, durch die viele manuelle Abläufe beschleunigt und qualitativ abgesichert werden. Andere Software-Systeme wie Computer Aided Design (CAD) und Engineering-Software (CAE) sowie Systeme zur Fertigungs- und Fabrikplanung (CAM/CAP) als auch Fertigungssteuerung (ERP) können einfach integriert werden.
Es ist allerdings festzustellen, dass bisher nur wenige Unternehmen in der Medizintechnik PLM-Systeme einsetzen. So wurde PLM wesentlich durch die großen Unternehmen aus der Automobil- und der Luftfahrtbranche geprägt. Aufgrund jahrelanger Entwicklungsprozesse und Zulassungsfristen sowie wegen häufig hoher Investitionskosten und der Nutzungsdauer der Produkte lohnt allerdings die Einführung eines PLM-Systems für Medizingerätehersteller besonders, wie folgende Beispiele aus der Praxis zeigen.
PLM bei Medizingeräteherstellern
Um Entwicklungsprozesse völlig neuer Produkte in erheblich kürzerer Zeit durchzuführen und dabei den Innovationsgrad zu steigern, hat sich die israelische Lumenis Ltd. als weltgrößter Entwickler und Hersteller medizinischer Lasergeräte intensiv mit den Möglichkeiten von PLM beschäftigt und sich Ende 2011 für PLM und die PLM-Plattform Enovia V6 entschieden. In besonderem Maße profitieren die Lumenis-Entwickler dabei vom “ENOVIA Life Science Accelerator”. Diese Komponente hilft dabei, die Anforderungen hinsichtlich Qualität und Zulassungsbedingungen einzuhalten. Durch die integrierte Online-Kooperationsplattform können die verschiedenen Lumenis Mitarbeiter auf die für sie relevanten Daten zu jedem Zeitpunkt und von jedem Ort aus zugreifen. Dabei können sie sicher sein, dass sie auch mit den aktuellen Daten arbeiten. Dieser Vorteil wird durch die sichere und vollständige Nutzung des Firmen-Know-hows zusätzlich verstärkt. Und schließlich kann die Kooperationsplattform auch unternehmensübergreifend das Zusammenwirken mit Zulieferern, Vertrieb, Händlern und Kunden koordinieren und somit die gesamte Zulieferkette kontrollieren.

Bild 3: Von anderen Branchen lernen:
Rollstuhlhersteller profitiert vom Wissen der
Automobilindustrie
(Bild: Sunrise Medical).
Als eines von wenigen Unternehmen in der Medizintechnik hat sich der führende Hersteller manueller und elektrischer Rollstühle Sunrise Medical, Fresno, CA, USA, bereits frühzeitig mit PLM beschäftigt. Da Rollstühle von den technologischen Erkenntnissen und Erfahrungen der Automobilhersteller profitieren, war auch eine Software, die in dieser Branche eine große Bedeutung hat, für den Hersteller interessant. Sunrise Medical vertraute daher schon 1999 auf die Expertise, die MatrixOne, ein Vorreiter moderner PLM-Lösungen, in der Automobilindustrie gesammelt hatte. Heute setzt Sunrise Medical auf die Plattform Enovia V6, die MatrixOne als Kernbestandteil integriert, um die Produkte schneller und effizienter zu entwickeln und dadurch besser auf Marktanforderungen reagieren zu können [11].
Ausblick
Die Aufgaben von PLM-Systemen bei Anwendern im Bereich Medizintechnik fokussieren im Allgemeinen Produkt- und Prozessoptimierungen, wobei gleichzeitig Investitions- und Betriebskosten sinken sollen. Dabei bietet PLM eine Plattform, die den gesamten Entwicklungsprozess mit den Qualitätsprozessen in einer Softwareumgebung vereint. Die wichtigsten Vorteile eines PLM-Systems für Medizingerätehersteller sind die zulassungskonforme Verwaltung von Dokumenten und das Arbeiten in festen Workflows. So können Produktzulassungen in der Regel einfacher organisiert und schneller erreicht werden.
Um PLM in Unternehmen methodisch einzuführen und um die jeweils vorhandene Hard- und Software mit dem neuen PLM-System reibungslos zu verknüpfen, begleiten Lösungsanbieter wie die Pumacy Technologies AG diese Unternehmen bei der Gestaltung der Prozesse und der Einführung, Anpassung und Weiterentwicklung des neuen Systems. Pumacy schöpft dabei aus den zahlreichen interdisziplinären Erfahrungen als Anbieter von Wissens-, Innovations- und Prozessmanagement-Lösungen und trägt so in erheblichem Maße zu Erhöhung der Produktsicherheit bei Medizingeräteherstellern bei.
Schlüsselwörter:
Product Lifecycle Management, Medizintechnik, Dokumentenmanagement, ProzessmanagementLiteratur:
[1] Institut der deutschen Wirtschaft Köln: Deutsche Industrie – Chancen durch Megatrends. URL: http://www.iwkoeln.de/_storage/asset/55139/storage/master/file/267297/do..., Abrufdatum 17.7.2012.
[2] Gronau, R.: Medizinprodukte in Europa
– Vorschläge zur Nachjustierung anforderungsgerechter Instrumentarien sichern hohes Schutzniveau! In: mt-Medizintechnik 132 (2012) 3, S. 87.
[3] Haake, S.: Der CE Routenplaner, Kap.13101, TÜV Media, 2012. Bundesregierung: Strategieprozess MedTech. URL: http://www.strategieprozess-medizintechnik.de/entwicklung, Abrufdatum 17.7.2012.
[4] Bundesregierung: Strategieprozess MedTech. URL: http://www.strategieprozess-medizintechnik.de/entwicklung, Abrufdatum 17.7.2012.
[5] Baumann, R.; Dörr, N.; Landgraf, K.; Langenberg, D.: Integration von Innovationsmanagement in den Produktlebenszyklus. In: ZWF Zeitschrift für wirtschaftlichen Fabrikbetrieb 106 (2011) 6, S. 458-461.
[6] Hayka, H.; Langenberg, D.; Stark, R.: Kooperationsplattformen für virtuelle Unternehmen. In: ZWF Zeitschrift für wirtschaftlichen Fabrikbetrieb 105 (2010) 7-8, S.693-699.
[7] Grefenstette, G.; Wilber, L.: Search-Based Applications: At the Confluence of Search and Database Technologies. 1. Auflage. 2011.
[8] Abramovici, M.; Schulte, S.: PLM – Neue Bezeichnung für alte CIM-Ansätze oder Weiterentwicklung von PDM? In: Konstruktion – Zeitschrift für Produktentwicklung und Ingenieur-Werkstoffe (2005) 1/2, S. 64-75.
[9] Kind, Chr.; Stark, R.: Prozessmanagement in der Produktentstehung. In: Jochem, R.; Mertins, K.; Knothe, T. (Hrsg): Prozessmanagement: Strategien, Methoden, Umsetzung. Düsseldorf 2010.
[10] Dassault Systèmes: PLM-Lösungen in der Medizintechnik. URL: http://www.3ds.com/de/solutions/life-sciences/medical-device, Abrufdatum 19.7.2012.
[11] MatrixOne: A Platform for the Future. URL: http://www.3ds.com/fileadmin/COMPANY/CUSTOMER-STORIES/PDF/Sunrise-Medica..., Abrufdatum 20.7.2012.
